O Enem avalia os candidatos por meio de questões envolvendo situações-problema, que o aluno deve resolver articulando os dados do enunciado com seus conhecimentos acumulados durante sua trajetória escolar.
O Equilíbrio Químico é um assunto que é sempre abordado na prova de Ciências da Natureza no Enem, assim como ocorre na maioria das provas de vestibulares por todo o Brasil. Contudo, para resolver as questões de equilíbrio, o aluno deve dominar todos os contextos que podem ser abordados sobre o assunto, tais como: características do equilíbrio, interpretação de gráficos, cálculo da constante de equilíbrio e tipos de deslocamento em uma reação.
O que é Equilíbrio Químico?
Antes de tudo, o aluno deve compreender o conceito de Equilíbrio Químico e quando ele corre, pois somente assim ele irá identificar que é esse o assunto abordado na questão do Enem. Veja:
- Equilíbrio Químico é a situação na qual o sistema observado apresenta duas reações ocorrendo em sentidos contrários e com mesma velocidade. Por isso, para ocorrer é necessário que as reações sejam reversíveis.
Mas o que é uma reação reversível? É aquela que pode ocorrer nos dois sentidos (reação direta e reação inversa). Nas reações reversíveis, tanto os reagentes quanto os produtos são consumidos e formados simultaneamente. Por isso, o equilíbrio é atingido quando a velocidade a reação direta é igual da reação inversa (Vd=Vi). Isso é indicado pela dupla seta nas reações.
Características do Equilíbrio Químico
- Ocorre em sistema fechado e a temperatura constante;
- As velocidades das reações diretas e inversas são iguais;
- As concentrações de reagentes e produtos permanecem constantes, porém não necessariamente iguais.
- O grau de equilíbrio é expresso em porcentagem e pode ser obtido pela expressão:

- As propriedades macroscópicas permanecem constantes, por exemplo, cor, estado físico, etc.
Tipos de Gráficos
1º Caso) Concentração dos Reagentes é igual a concentração dos Produtos

Nesse tipo de gráfico, a [R]=[P] indica que o equilíbrio não esta deslocando e as reações direta e inversa possuem mesma intensidade.
2º Caso ) A Concentração dos Reagentes é maior que a concentração dos Produtos

Nesse segundo caso, o equilíbrio está deslocando-se para esquerda, pois a reação inversa, com formação de reagentes, está ocorrendo com maior intensidade que dos produtos.
3º caso) A Concentração de Produtos é maior que a concentração de Reagentes
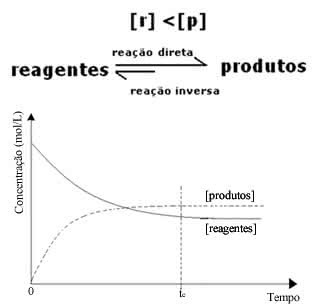
Em último caso, o equilíbrio está deslocando-se para direita, pois a reação direta, com formação de produtos, está correndo em maior intensidade que dos reagentes.
Constante de Equilíbrio (K)
Para calcular a constante de equilíbrio de uma reação, utiliza-se a concentração molar dos participantes, Kc é dada pelo quociente:

Veja em exemplo de uma reação genérica:

Assim: 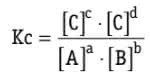
Características da Constante de Equilíbrio
- O valor de Kc depende da reação considerada e da temperatura e não depende das concentrações inciais dos reagentes.
- As substâncias em estado sólido possuem concentrações constantes e, por isso, não devem ser utilizadas no cálculo da constante de equilíbrio.
- Para reações que envolvem líquidos, o aumento da concentração de um dos reagentes leva a um aumento na velocidade da reação, uma vez que conforme ocorre o aumento da concentração, aumenta-se também a frequência de colisões entre as moléculas. Porém, isso só deverá ser considerado quando o reagente analisado faça parte da lei de velocidade.
- Quando os coeficientes estequiométricos de uma reação balanceada forem multiplicadas por algum fator, por exemplo, o 2, a Kc fica elevada a esse fator: Kc nova = (Kc antiga)².
- Quando duas ou mais equações químicas são somadas para obter-se a equação global de uma reação, a constante de equilíbrio global é obtida pelo produto das Kc individuais de cada equação: Kglobal: Kc1 + Kc2…
Deslocamento de Equilíbrio Químico
Deslocar o equilíbrio de uma reação significa beneficiar temporariamente uma das velocidades diante de alguma pertubação do sistema reacional.
Esse mecanismo ocorre a fim de anular essa pertubação, de modo a voltar ao estado de equilíbrio anterior ou, em casos que ocorre pertubação devido a variação de temperatura, para criar uma novo estado de equilíbrio.
Existem três fatores capazes de perturbar um sistema em equilíbrio são:
- 1 – Concentração de produtos ou reagentes: o aumento de [R] ou [P] desloca o equilíbrio para o lado contrário da pertubação. Logo, a diminuição da concentração do produto ou do reagente desloca o equilíbrio para o lado que ocorreu a pertubação.
- 2 – Pressão: o aumento da pressão sobre um sistema gasoso desloca o equilíbrio para o lado da equação que tem menor número de mols do gás.
- 3 – Temperatura: o aumento na temperatura do sistema pode acarretar em uma pertubação no sistema, porém favorece mais a reação endotérmica – que ocorre com maior absorção de energia.
Adição de Catalisadores no sistema
A adição de um catalisador em um sistema em equilíbrio aumenta na mesma quantidade as velocidades da reação direta e inversa. Esse catalisador pode até fazer com que o equilíbrio seja atingido mais rapidamente, mas não beneficia nenhuma das reações. Logo, não desloca o equilíbrio.
Como cai Equilíbrio Químico no Enem
As questões de Equilíbrio Químico no Enem são interdisciplinares e contextualizadas com a realidade, sendo assim, esse conteúdo pode ser abordado em questões sobre problemas ambientais, em aplicações industriais e na tecnologia.
Na indústria, o equilíbrio químico é utilizado para obtenção de produtos de grande importância para o comércio, por exemplo, a amônia, o ácido nítrico, ácido sulfúrico. Esse mecanismo tem como principal benefício a minimização das perdas de reagentes e assim, maximizar o lucro.
Veja um exemplo:

Gabarito Gabarito: Letra A
Gostou da Revisão de Equilíbrio Químico no Enem? Deixe um comentário abaixo e compartilhe nas redes sociais. 🙂




Comente