A termoquímica é a área da química que estuda a quantidade de calor (energia) produzida em uma reação química. O assunto é abordado nas questões de Química da prova de Ciências da Natureza de forma recorrente nos últimos cinco anos.
As questões sobre Termoquímica no Enem abordaram a aplicação do conceito de energia, transferência de energia, valor de entalpia (∆H) por meio da aplicação da Lei de Hess.
Pensando nisso, selecionamos as dez melhores questões sobre o assunto para que você possa testar seus conhecimentos sobre o assunto e tirar suas dúvidas. Abaixo de cada questão é possível conferir o gabarito e um vídeo com a resolução detalhada. Confira abaixo:
Questões sobre Termoquímica no Enem: resolva agora
01 – (Enem 2016) O benzeno, um importante solvente para a indústria química, é obtido industrialmente pela destilação do petróleo. Contudo, também pode ser sintetizado pela trimerização do acetileno catalisada por ferro metálico sob altas temperaturas, conforme a equação química:
3 C2H2 → C6H6(l)
A energia envolvida nesse processo pode ser calculada indiretamente pela variação de entalpia das reações de combustão das substâncias participantes, nas mesmas condições experimentais:
I. C2H2(g) + 5/2O2(g) → 2CO2(g) + H2O(l) ∆Hco = –310 kcal/mol
II. C6H6(l) + 15/2O2(g) à 6CO2(g) + 3H2O(l) ∆Hco = –780 kcal/mol
A variação de entalpia do processo de trimerização, e kcal para a formação de um mol de benzeno é mais próxima de,
a) 1.090.
b) -150.
c) -50.
d) +157.
e) +470
GABARITO: Letra B
Veja resolução abaixo:
https://www.youtube.com/watch?v=Xf1G3w_B9VU&ab_channel=ProfessorGabrielCabral
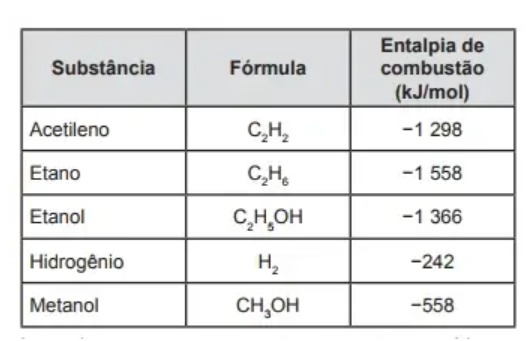
02 – (Enem PPL 2014) A escolha de uma determinada substância para ser utilizada como combustível passa pela análise da poluição que ela causa ao ambiente e pela quantidade de energia liberada em sua combustão completa. O quadro apresenta a entalpia de combustão de algumas substâncias. As massas molares dos elementos H, C e O são, respectivamente, iguais a 1 g/mol, 12 g/mol e 16 g/mol.
Levando-se em conta somente o aspecto energético, a substância mais eficiente para a obtenção de energia, na combustão de 1 kg de combustível, é o
a) Etano.
b) Etanol.
c) Metanol.
d) Acetileno.
e) Hidrogênio.
GABARITO: Letra E
Veja resolução abaixo:
03 – (Enem 2019) A Glicólise é um processo que ocorre nas células, convertendo glicose em piruvato. Durante a prática de exercícios físicos que demandam grande quantidade de esforço, a glicose é completamente oxidada na presença de O2. Entretanto, em alguns casos, as células musculares podem sofrer um déficit de O2 e a glicose ser convertida em duas moléculas de ácido lático. As equações termoquímicas para a combustão da glicose e do ácido lático são, respectivamente, mostradas a seguir:
C6H12O6 (s) + 6 O2 (g) → 6 CO2 (g) + 6 H2O (l) ∆cH = −2 800 kJ
CH3CH(OH)COOH (s) + 3 O2 (g) → 3 CO2 (g) + 3 H2O (l) ∆cH = −1 344 kJ
O processo anaeróbico é menos vantajoso energeticamente porque
a) libera 112 kJ por mol de glicose.
b) libera 467 kJ por mol de glicose.
C) libera 2 688 kJ por mol de glicose.
d) absorve 1 344 kJ por mol de glicose.
e) absorve 2 800 kJ por mol de glicose.
GABARITO: Letra A
Veja resolução abaixo:
04 – (Enem 2018 PPL) Bebidas podem ser refrigeradas de modo mais rápido utilizando-se caixas de isopor contendo gelo e um pouco de sal grosso comercial. Nesse processo ocorre o derretimento do gelo com consequente formação de líquido e resfriamento das bebidas. Uma interpretação equivocada, baseada no senso comum, relaciona esse efeito à grande capacidade do sal grosso de remover calor do gelo.
Do ponto de vista científico, o resfriamento rápido ocorre em razão da
a) variação da solubilidade do sal.
b) alteração da polaridade da água.
c) elevação da densidade do líquido.
d) modificação da viscosidade do líquido.
e) diminuição da temperatura de fusão do líquido.
GABARITO: Letra E
Veja resolução abaixo:
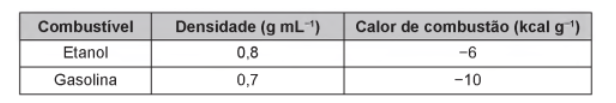
05 – (Enem 2018) O carro flex é uma realidade no Brasil. Estes veículos estão equipados com motor que tem a capacidade de funcionar com mais de um tipo de combustível. No entanto, as pessoas que têm esse tipo de veículo, na hora do abastecimento, têm sempre a dúvida: álcool ou gasolina? Para avaliar o consumo desses combustíveis, realizou-se um percurso com um veículo flex, consumindo 40 litros de gasolina e no percurso de volta utilizou-se etanol. Foi considerado o mesmo consumo de energia tanto no percurso de ida quanto no de volta.
O quadro resume alguns dados aproximados sobre esses combustíveis.
a) 27
b) 32
c) 37
d) 58
e) 67
GABARITO: Letra D
Veja resolução abaixo:
06 – (Enem 2018) Por meio de reações químicas que envolvem carboidratos, lipídeos e proteínas, nossas células obtêm energia e produzem gás carbônico e água. A oxidação da glicose no organismo humano libera energia, conforme ilustra a equação química, sendo que aproximadamente 40% dela é disponibilizada para atividade muscular.
C6H12O6( s ) + 6 O2 (g) → 6 CO2 (g) + 6 H2O (I) ΔcH= -2 800 kJ
Considere as massas molares (em g mol-1): H = 1; C=12; O = 16.
Na oxidação de 1,0 grama de glicose, a energia obtida para atividade muscular, em quilojoule, é mais próxima de
a) 6,2.
b) 15,6.
c) 70,0.
d) 622,2.
e) 1 120,0.
GABARITO: Letra A
Veja resolução abaixo:
07 – (Enem 2016) Atualmente, soldados em campo, seja em treinamento ou em combate, podem aquecer suas refeições, prontas e embaladas em bolsas plásticas, utilizando aquecedores químicos, sem precisar fazer fogo. Dentro dessas bolsas existe magnésio metálico em pó e, quando o soldado quer aquecer a comida, ele coloca água dentro da bolsa, promovendo a reação descrita pela equação química:
Mg (s) + 2 H2O (I) → Mg(OH)2 (s) + H2 (g) + 350 kJ
O aquecimento dentro da bolsa ocorre por causa da
a) redução sofrida pelo oxigênio, que é uma reação exotérmica.
b) oxidação sofrida pelo magnésio, que é uma reação exotérmica.
c) redução sofrida pelo magnésio, que é uma reação endotérmica.
d) oxidação sofrida pelo hidrogênio, que é uma reação exotérmica.
e) redução sofrida pelo hidrogênio, que é uma reação endotérmica.
GABARITO: Letra B
Veja resolução abaixo:
08 – (Enem 2017) O ferro é encontrado na natureza na forma de seus minérios, tais como a hematita (α-Fe2 O3), a magnetita (Fe3O4) e a wustita (FeO). Na siderurgia, o ferro-gusa é obtido pela fusão de minérios de ferro em altos fornos em condições adequadas. Uma das etapas nesse processo é a formação de monóxido de carbono. O CO (gasoso) é utilizado para reduzir o FeO (sólido), conforme a equação química:
FeO (s) + CO (g) → Fe (s) + CO2(g)
Considere as seguintes equações termoquímicas:
Fe2O3 (s) + 3 CO (g) → 2 Fe (s) + 3 CO2 (g) ΔrH = -25 kJ/mol de Fe2O3
3 FeO (s) + CO2 (g) → Fe3O4 (s) + CO (g) ΔrH = -36 kJ/mol de CO2
2 Fe3O4 (s) + CO2 (g) → 3 Fe2O3 (s) + CO (g) ΔrH = +47 kJ/mol de CO2
O valor mais próximo de ΔrH , em kJ/mol de FeO, para a reação indicada do FeO (sólido) com o CO (gasoso) é
a) -14.
b) -17.
c) -50.
d) -64.
e) – 100
GABARITO: Letra B
Veja resolução abaixo:
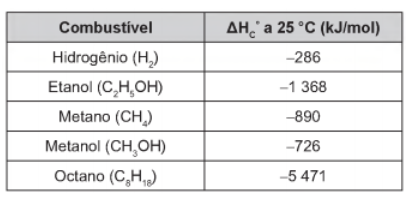
09 – (Enem 2016) Para comparar a eficiência de diferentes combustíveis, costuma-se determinar a quantidade de calor liberada na combustão por mol ou grama de combustível. O quadro mostra o valor de energia liberada na combustão completa de alguns combustíveis.
Qual combustível apresenta maior liberação de energia por grama?
a) Hidrogênio.
b) Etanol.
c) Metano.
d) Metanol.
e) Octano.
GABARITO: Letra A
Veja resolução abaixo:
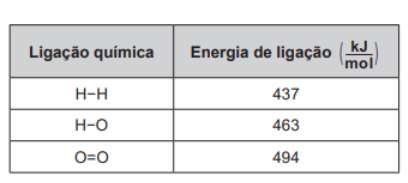
10 – (Enem 2019 PPL) O gás hidrogênio é considerado um ótimo combustível — o único produto da combustão desse gás é o vapor de água, como mostrado na equação química.
2 H 2 (g) + O 2 (g) → 2 H 2O (g)
Um cilindro contém 1 kg de hidrogênio e todo esse gás foi queimado. Nessa reação, são rompidas e formadas ligações químicas que envolvem as energias listadas no quadro.
Qual é a variação da entalpia, em quilojoule, da reação de combustão do hidrogênio contido no cilindro?
a) −242 000
b) −121 000
c) −2 500
d) +110 500
e) +234 000
Veja resolução abaixo:




Comentários
Bons exemplos e foi possível aprender.